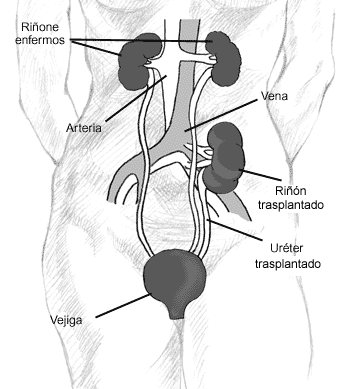
Actualmente, el trasplante renal es el tratamiento de elección en niños con IRCT, presentando una mayor supervivencia que la dialisis y un correcto desarrollo pondoestatural, social y psicointelectual. Las indicaciones de trasplante se han ampliado con los años, de modo que hoy en día la indicación de trasplante renal es la insuficiencia renal con síntomas que no pueden eliminarse mediante tratamiento conservador.
En la edad pediàtrica, especialmente en menores de dos años, está especialmente indicado el trasplante de donante vivo, ya que la supervivencia es mayor que con riñones procedentes de cadáver. Como complicaciones, pueden aparecer rechazo, HTA, infecciones, neoplasias, efectos secundarios de la immunosupresión y recidivas de la enfermedad renal, a parte de las complicaciones propias de la cirugía.
Los resultados a 5 años han mejorado en las últimas 5 décadas, siendo la mortalidad del niño trasplantado menor del 5%. La supervivencia del injerto puede alcanzar el 90% en los riñones de donante vivo y el 70% los de donante cadàver. Factores relacionados con la supervivencia del injerto son la edad (peor en receptores menores de 2 años), la diálisis pretrasplante, el rechazo agudo y la raza (mejor en caucásicos).
Actualmente, el trasplante renal es el tratamiento de elección en niños con IRCT (1,2).
El primer éxito del trasplante renal llegó con Murray en 1954 que realizó un trasplante renal entre gemelos homocigotos (3). Hubo que esperar hasta finales de los años 60 para que se realizasen los primeros trasplantes en edad pediátrica.
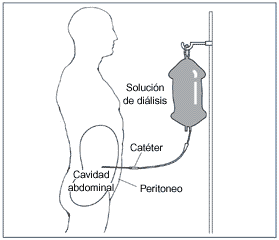
Tanto la diálisis; bien peritoneal o hemodiálisis, no son capaces de recuperar el crecimiento del niño y el desarrollo psico-intelectual.
La diálisis representaría hoy día una alternativa para el niño con insuficiencia renal, sin donante vivo, en espera del trasplante o para aquellos niños que por diferentes causas la posibilidad de trasplante resultara muy remota. En el resto de casos, el trasplante es la primera alternativa.
Un niño que se encuentra en período de crecimiento con un clearence de creatinina inferior a 20 ml/mi/1,73 m2 y donante vivo tiene indicaciones suficientes para ser trasplantado. Por lo tanto, no hay motivo para someter a un niño, con donante vivo, a diálisis.
El injerto procedente de donante vivo ofrece claras ventajas, particularmente en niños. El hecho de que la cirugía pueda ser programada hace que se realice en circunstancias óptimas. El tiempo de preservación es más corto. La compatibilidad inmunológica entre donante y receptor favorece la superviviencia del injerto.
El trasplante renal pediátrico no sólo logra restablecer la función renal sino también asegura un correcto desarrollo estatoponderal, social y psico-intelectual.
ETIOLOGÍA DE LA INSUFICIENCIA RENAL CRÓNICA
La etiología de la insuficiencia renal crónica (IRC) en los niños difiere de la de los adultos. En 1973, Habib y col. (4) revisaron la etiología de la IRC y encontraron cinco clases distintas de enfermedades renales que conducían a la misma: las nefropatías glomerulares, las nefropatías hereditarias, la hipoplasia renal, las malformaciones de las vías urinarias y las nefropatías vasculares.
Entre las Glomerulopatías se encuentran las siguientes entidades: glomerulonefritis crónica, focal, membranoproliferativa, rápidamente progresiva, membranosa, lupus eritematoso, púrpura de Schonlein-Henoch, síndrome hemolítico-urémico, nefritis por anticuerpos antimembrana, síndrome de Goodpasture, nefritis, nefropatía por IgA.
En cuanto a Congénitas o Hereditarias: uropatía obstructiva, displasia o hipoplasia renal, nefritis familiar, enfermedad quística medular, cistinosis, riñones poliquísticos (infantil), oligoma-ganefrania, enfermedad por depósitos de glicógeno.
Síndromes hereditarios: displasia retinorrenal, Alport, Nail-Patella,Lawrence-Moon-Bield, Charcot-Marie-Tooth, Jeune.
Otras causas serían: tumor de Wilms, necrosis cortical, nefropatía por células de hoz, neuroblastoma, síndrome de Bartter, nefropatía tóxica, hemofilia, trombosis de venal renal.
Algunas de las patologías citadas tienen un índice de recidiva muy alto, como la hiperoxaluria, la glomeruloesclerosis focal y segmentaria. Otras, como el síndrome hemolítico urémico son impredecibles en cuanto a su evolución postrasplante.
CRITERIOS DE ACEPTABILIDAD DEL RECEPTOR
En 1968, Merril (5) enunció diversos factores que pensó eran importantes para la selección de los pacientes. Estos factores fueron: edad, fracaso del tratamiento conservador, ausencia de factores reversibles, vías urinarias bajas normales, ausencia de complicaciones extrarrenales mayores, ausencia de infección y desnutrición, ausencia de reacciones previas de sensibilidad y ausencia de pancitopenia.
Hoy en día, la indicación básica para el trasplante renal es la insuficiencia renal con síntomas que no puedan eliminarse por medio de tratamientos conservadores.
Edad del receptor
El niño debe tener la edad y peso suficiente como para poder recibir un injerto de un adulto.
En la década de los años 70 se cuestionaba el trasplante a niños menores de 1 año debido a que conllevaba escaso éxito con elevada mortalidad (85%).
Posteriormente los resultados han ido mejorando como demostró la experiencia publicada de So y cols (6) en 1987 y Rizzioni (7). Este último observó que los niños menores de 5 años que recibían un injerto procedente de donante vivo presentaban mayor supervivencia a los 5 años (63%) que aquellos que recibían un injerto procedente de donante cadáver (20%). Briscoe (8) (1992) no encuentra diferencias entre receptores menores de 2 años con los mayores a estos. La NAPRTCS (1992) concluye que la edad menor a 2 años es un factor pronóstico negativo si se implanta un injerto procedente de donante cadáver. Warady (9) atribuye la diferencia de los resultados entre ambos estudios a la experiencia del equipo médico-quirúrgico, el uso de donantes jóvenes y a las diferentes pautas de inmunosupresión.
Meseguer (10) (1993) destaca una supervivencia del receptor e injerto del 85% a los 36 meses en 7 niños menores de 2 años.
Chavers (11) en su estudio sobre 164 trasplantes en menores de 18 años determina que los menores de 2 años padecían mayor riesgo de infección bacteriana en el postoperatorio y los mayores a esta edad mayor incidencia de rechazo agudo.
Además de la edad, se tendrán en cuenta otros factores al establecer la indicación del trasplante como el crecimiento y estado nutricional, estado mental, desarrollo psicomotor, la presencia de infección generalizada, enfermedades sistémicas activas, neoplasias malignas.
Estado mental
En cuanto al estado mental no hay contraindicación en realizar el tratamiento a un niño con IRCT y retraso mental siempre y cuando se dé el adecuado y extenso consejo a los padres y éstos acepten el trasplante.
Estado psicoemocional (13,14,15)
El problema que pueden presentar niños con IRCT que sufren de trastornos de la conducta o psiquiátricos es la falta de adaptabilidad al plan terapéutico. Korsch, Fine y Negrete (12) (1978) ya observaron rechazo de los injertos o función renal alterada en niños que habían interrumpido el tratamiento inmunosupresor debido a su inadaptabilidad. Por lo tanto sería importante detectar este tipo de pacientes para evitar pérdida de injertos. Se recomendaría diferir el trasplante hasta tener la seguridad de poder manejar el período postrasplante desde el punto de vista psicoemocional.
PREPARACIÓN DEL RECEPTOR
En primer lugar se evaluará el peso del receptor pediátrico. Por encima de 10-12 Kg la mayoría de los niños tiene espacio suficiente para poder recibir el riñón de un adulto.
El receptor deberá estar libre de infecciones o anomalías anatómicas que predispongan a éstas.
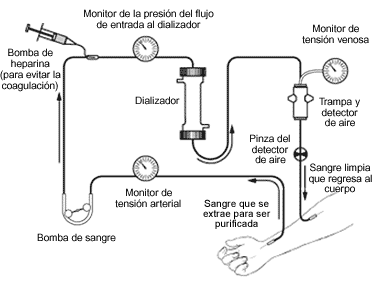
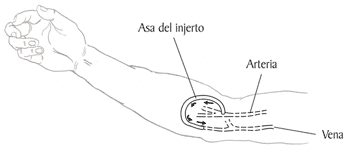
Es importante disponer de una vía de acceso para diálisis en previsión de episodio de oligoanuria, bien por insuficiencia renal aguda o episodio grave de rechazo.
Se reconvertirán, si es posible, las derivaciones urinarias o intestinales. Las plastias de agrandamiento vesical constituyen una alternativa para disponer de forma ideal de un sistema urinario no derivado antes del trasplante Se corregirán las anomalías anatómicas del tracto urinario. Las complicaciones urológicas del trasplante son mayores en niños con enfermedad urológica primaria.
Se estudiarán la vejiga y la uretra realizando uretrocistografía miccional. Además, en presencia de historia de disfunción del tracto urinario inferior se valorará la realización de uretrocistoscopia y estudio urodinámico. Ante una vejiga neurógena con flujo urinario se intentará estabilizar la función vesical antes del trasplante.
Se realizará nefrectomía de riñones primitivos en el caso de hipertensión arterial severa, reflujo vésico- ureteral con uréteres muy largos, infecciones recurrentes del tracto urinario o proteinuria masiva.
TECNICA QUIRÚRGICA
Se seguirá la misma técnica quirúrgica que en el adulto cuando el peso del niño a trasplantar sea igual o superior a 20 kg. Si el peso fuera menor existen algunas variantes técnicas.
Casi siempre se colocará el injerto de forma extraperitoneal cuando el peso del receptor sea superior a 20 kg . Las anastomosis vasculares se realizan a los vasos ilíacos y/o hipogástricos. Incluso, a veces, a aorta y vena cava inferior. Se realizan de forma término- lateral.
Si el peso del receptor es inferior a 10 kg es mejor colocar el riñón intraabdominal, detrás de ciego y colon ascendente (16). Se realiza una laparotomía media suprainfraumbilical. Se abre peritoneo lateralmente al colon ascencente y éste se rechará medialmente. Se disecan aproximadamente 4 cm de vena cava y aorta terminal. El clampaje de estos vasos se hace de forma parcial con un clamp vascular, dejando justo la zona a realizar la anastomosis. Estas se realizan de forma término-lateral; primero venosa y después arterial. Se vigilará la respuesta del receptor durante el tiempo del clampaje-desclampaje vascular. El uréter se sitúa de forma retroperitoneal de manera que cruce a la arteria ilíaca común y su reimplantación se realiza igual que en los adultos, es decir, mendiante una ureteroneocistostomía, a no ser que existan anomalías vesicales.
Finalizado el trasplante, el colon ascendente se coloca por encima de la superficie del injerto, en su posición habitual.
En niños con un peso comprendido entre 10- 20 kg, su espacio retroperitoneal podría alojar un riñón pequeño y los vasos se pueden anastomosar a aorta terminal y vena cava o ilíaca común (17). (Figura 1).

CONSIDERACIONES ANESTÉSICAS (19)
Es importante, durante la intervención, una atención cuidadosa a un volumen intravascular adecuado. Un defecto de volemia aumentaría el riesgo de trombosis vascular o necrosis tubular aguda. Un exceso de volemia podría producir problemas en los parámetros respiratorios (edema agudo de pulmón). La presión venosa central y la arterial estarán monitorizadas. La PVC se mantendrá entre 10-14 cm H20 y la TA por encima de 7 mm Hg antes del desclampaje.
Se pueden administrar cristaloides o coloides antes de desclampar con el fin de evitar la hipotensión.
Se puede utilizar drogas como dopamina para asegurar el mantenimiento de la TA y la vasodilatación renal cuando la función cardíaca no sea totalmente adecuada. La dosis: 2-4 microgramos/kg/ minuto.
Se administrará furosemida y manitol durante las anastomosis a dosis de 2-4 mg/kg y 0,5-1g/kg respectivamente para favorecer la diuresis posterior al desclampaje.
En el período de postrasplante se vigilará estrictamente la diuresis. La PVC no debe bajar de 6 cm H20. Se repondrá el volumen perdido de diuresis con suero salino fisiológico al 0,33% o 0,45%. Atención a una posible hipokaliemia y a la acción de un posible tercer espacio debida a una ascitis en niños que habían sido tratados previo al trasplante con diálisis peritoneal.
La fluidoterapia se puede empezar a disminuir una vez se restablece la función renal (20).
COMPLICACIONES (8)
CLÍNICAS
RECHAZO.
El rechazo hiperagudo es muy raro. El rechazo agudo se presenta en un 50% de trasplantes con injertos procedentes de donante vivo (un 15% más aproximadamente con injertos de donante cadáver). Los síntomas: fiebre, oliguria, HTA, ascenso de creatinina, dolor a la palpación. Para hacer un diagnóstico diferencial entre rechazo vs nefropatía de novo, toxicidad por ciclosporina y necrosis tubular aguda recurriremos a la biopsia renal.
HTA.
De etiología multifactorial:
• Corticoterapia.Podría estar relacionado con la reactivdad vascular, aumento de la actividad de la bomba sodio-potasio y aumento del volumen plasmático.
• Ciclosplorina A. Se observa aumento de la resistencia vascular y estimulación del sistema renina-angiotensina- aldosterona.
• Estenosis de la arteria renal. Raro. Para el diagnóstico se realizará un estudio con Eco-doppler.
INFECCIONES
Primera causa de mortimorbilidad en el primer año (21).
• Bacterianas. Muy comunes durante el primer mes postrasplante, sobretodo las de herida quirúrgica, respiratorias y urinarias (22). Atención a las infecciones neumocócicas en pacientes esplenectomizados.
• Víricas. La infección por Citomegalovirus (CMV) es la más frecuente independientemente de la edad. Suele manifestarse de 1-3 meses postrasplante. Suele se primaria, transmitida por transfusiones, infección latente reactivada por el efecto de la inmunosupresión o por el trasplante. El 90% se autolimitan y son asintomáticas; en 5-10 % pueden causar éxitus. Pueden provocar la pérdida del injerto de forma directa.
• Micóticas.La aparición de infecciones micóticas asociadas a la administración de antibióticos de amplio espectro y de corticosteroides es un hecho bien establecido.
RECIDIVA DE LA ENFERMEDAD RENAL
La enfermedad que llevó a la IRCT puede recidivar en el riñón trasplantado. Destacan: glomeruroloesclerosis focal y segmentaria, oxalosis, glomerulopatía membranosa, síndrome de Alport. Se perdería el injerto en 50% de los casos.
NEOPLASIAS MALIGNAS
Estos niños tienen mayor incidencia de tumores. Destacan: linfomas no Hodking, sarcoma de Kaposi, cáncer de piel, carcinoma hepatobiliar (23).
QUIRÚRGICAS
Las complicaciones quirúrgicas ponen en peligro la sobrevida del injerto. Las más frecuentes son las urológicas y las vasculares.
UROLÓGICAS
• Fístula urinaria. Las ureterales se deben a necrosis isquémica, como consecuencia de una lesión vascular, frecuentemente ocurrida durante la nefrectomía del donante. La fístula calicial es rara y suele se producida por un infarto renal secundario a ligadura de una arteria polar durante la extracción. La fístula vesical se debe generalmente a un cierre defectuoso de la cistostomía.
• Obstrucción ureteral. Cuando hay ascenso de creatinina en ausencia de signos clínicos de rechazo se debe sospechar esta complicación. Se puede presentar de forma precoz: puede deberse a edema, a necrosis distal del uréter o a un exceso de tensión ejercida durante el momento del trasplante. Se debe proceder a la exploración quirúrgica inmediata. El objetivo es restablecer un drenaje urinario normal, lo cual depende de la viabilidad del uréter.
Si la permeabilidad del uréter es dudosa, se procede a drenaje por nefrostomía, postergando el tratamiento quirúrgico de la obstrucción ureteral. La reparación se hace por medio de una reimplantación del uréter en vejiga, o mediante una anastomosis ureteroureteral, utilizando el uréter del receptor (cuando la necrosis del uréter del injerto es muy extensa). La obstrucción tardía se puede presentar bien a nivel de la unión ureteropiélica (que suele requerir de tratamiento quirúrgico reconstructivo definitivo)o ureterovesical (generalmente responde a dilatación ureteral) o secundario a la formación de cálculos.
VASCULARES
Son menos frecuentes pero casi siempre conllevan la pérdida del injerto. Son más frecuentes cuanto menor edad tiene el receptor y menor es su peso ya que los vasos también son más pequeños.
La trombosis arterial y venosa pueden presentarse en el postoperatorio inmediato. Bien por razones técnicas o inmunológicas o por compresión (venosa). El síntoma inicial es la anuria.
En el capítulo de complicaciones vasculares se describen más detalladamente.
LINFOCELE
Se forman por acúmulo de linfa en el retroperitoneo, debido a que en el momento de la disección de los linfáticos para preparar la fosa ilíaca, se realizan ligaduras inadecuadas.
El diagnóstico es por ecografía. Pueden llegar a comprimir el uréter produciendo una obstrucción extrínseca del mismo.
El tratamiento consiste en la marsupialización hacia la cavidad peritoneal. Realizaremos una ventana en el peritoneo para que la linfa pueda ser canalizada hacia éste y con ello reabsorvida.
INMUNOSUPRESION EN EL TRASPLANTE RENAL PEDIÁTRICO (24).
Se expone de manera esquemática el protocolo actual de la Unidad de Trasplante Renal Hospital Sant Joan de Déu, Hospital Clinico de Barcelona.
RESULTADOS
El resultado del trasplante renal en niños ha progresado notablemente en las últimas 5 décadas. La mortalidad del niño trasplantado es menor del 5%. La principal causa de muerte son las infecciones; aproximadamente en el 50% de los casos, seguida de las causas cardiovasculares. El pico de mortalidad más elevado se presenta en el primer año postrasplante. Las complicaciones médicas que pueden presentarse después de un trasplante son muchas pero las más frecuentes son: hipertensión, disfunción hepática, infecciones, fiebre prolongada y falta de adaptación.
La hipertensión podría deberse a la acción de los corticoides, rechazo agudo y crónico, estenosis de la arteria renal, dieta: a la elevada sensibilidad de los receptores pediátricos a la ingesta excesiva de sal. La disfunción hepática aparecida en algunos receptores puede ser atribuible a la toxicidad de la azatioprina. Al disminuir la dosis de dicho fármaco, en la mayoría de los casos se obtiene una buena respuesta. La administración de corticosteroides aumenta la susceptibilidad a las infecciones. También a síndrome de Cushing, acné, diabetes mellitus, cataratas, necrosis aséptica e hiperlipidemia. El buen funcionamiento del injerto en la mayoría de casos, se traduce en una rápida curación de la osteodistrofia renal que poseían los niños antes del trasplante. Fine y col (25) ya demostraron que existía una relación en los pacientes pediátricos receptores de trasplante con el peso del paciente, las dosis de corticosteroides y el desarrollo de cataratas después del trasplante. Pen (26) fue de los primeros en demostrar un aumento de la frecuencia de neoplasias malignas en los receptores de trasplantes.
Los injertos procedentes de donante vivo, obviamente, al tener mayor similitud inmunológica presentan mayor superviviencia. Si poseen HLA idéntico la supervivencia a los cinco años puede alcanzar el 90%, frente al 70% si proceden de donante cadáver. Según Ishitani et col (27). Factores que podrían predecir la supervivencia del injerto en niños que reciben un riñón procedente de donante vivo incluyen: edad en el momento del trasplante, diálisis pretrasplante o no, rechazo agudo y raza. Niños menores de 2 años inicialmente tienen peor supervivencia del injerto, sin embargo, con el tiempo los resultados se estabilizan y es con los 7 años de edad donde los injertos tuvieron la mejor supervivencia (71%). Adolescentes con edades comprendidas entre 13 y 18 años tienen la mejor supervivencia inicial del injerto pero con el paso del tiempo disminuye (55%). Pacientes que habían estado sometidos a tratamiento con diálisis pretrasplante tienen un riesgo relativo de pérdida del injerto de 1,41 (p<0,02). Pacientes afroamericanos tienen un riesgo relativo significativamente mayor de pérdida del injerto que los caucásicos o hispánicos. Resultados similares son publicados por the North American Pediatric Renal Transplant Cooperative Study (NAPRTCS) (28, 29) y the United Network for Organ sharing kidney transplant registry (UNOS) (30, 31).
La recurrencia de la enfermedad primaria supone la pérdida de aproximadamente el 5% de los injertos. Enfermedades que tienen alta incidencia en recurrir son: glomerulonefritis membranoproliferativa como ya apuntó Mc Lean (32) en 1976, glomerulonefritis focal y segmentaria (Hoyer et col (33) en 1972 fueron los primeros en reportar casos) y la cistinosis, entre otras. Si la enfermedad recurre inmediatamente después del trasplante con el primer injerto, esto indica que existe un riesgo evidente de recurrencia para los injertos sucesivos.
El trasplante renal proporciona un mejor desarrollo físico y psíquico, una mejor calidad de vida. Sin embargo, en algunos casos, persiste el retraso del crecimiento. Ya Pennisi y col (34) (1977) informaron que un crecimiento lineal normal no siempre ocurría después del trasplante. Según ellos, los factores responsables de esas bajas tasas de crecimiento fueron: potencial de crecimiento en el momento de realizarse el trasplante, sexo del receptor, funcionalidad del injerto y efecto retardado del crecimiento ejercido por los corticoides. Gruskin y Fine (35) (1973) fueron los primeros en informar que niños con una edad ósea superior a los 12 años en el momento de recibir el trasplante, crecían muy poco, en tanto que aquellos cuya edad ósea estaba por debajo de este límite proseguían con un crecimiento normal después del trasplante.
De lo expuesto se deduce que no hay que demorar el momento del trasplante a niños con IRCT y que disponen de un donante vivo.
Fuente: Servicio de Nefrología. Unidad Trasplante Renal. Hospital Clínico de Barcelona. España (Mª Pilar Luque Gálvez, Lluis Peri Cusi y Juan Manuel Corral Molina).